[재외연구자 소개] Stanford University School of Medicine_조상균 박사
관리자
view : 1001

성명: 조상균
이메일 주소: sangcho@stanford.edu
소속: Postdoctoral Fellow, Stanford University School of Medicine
Stanford Cardiovascular Institute (CVI)
Education:
2013 BS, Chemical and Biomolecular Engineering
Johns Hopkins University
2019 PhD, Chemical and Biomolecular Engineering
University of Pennsylvania
연구자 소개 (조상균, Sangkyun Cho, PhD)
저의 연구 비전은 심장 섬유증/섬유화를 기계생물학적(mechanobiological) 관점에서 이해하고, 섬유화의 발생 및 제어 기전을 규명하여 이를 기반으로 새로운 치료법을 개발하는 것입니다. 이를 위하여 저는 박사과정 때부터 생명공학, 생물리학, 재료공학 등 다양한 분야의 융합 학문 트레이닝을 받는 데 정진하였습니다. 박사과정 동안에는 기계생물학의 세계적인 권위자인 University of Pennsylvania (UPenn)의 Dennis Discher 교수님의 지도 아래 세포외기질의 생물리학적 특성들이 어떻게 세포의 행동 및 기능에 영향을 주는지 연구하였고, 구체적으로는 외부의 기계/물리적 신호들이 어떻게 세포들에 의해 감지되고 핵막/핵까지 이르러 다운스트림 유전자 발현을 조절하는지를 밝혀내는 데 집중하였습니다. ‘신규 항섬유화 치료법 개발’이라는 장기적인 목표를 위해서는 다양한 심혈관계 질환에 대한 폭넓은 임상 지식뿐만 아니라 여러 레벨의 질병 모델 (환자 유래 유도만능줄기세포, 조직공학 기반 3D 티슈 플랫폼, 생쥐 모델 등)을 활용하는 통합적 연구 경험이 뒷받침되어야 한다고 판단하여, 심혈관계 생리학 및 줄기세포 연구의 세계적인 전문가이신 Stanford Cardiovascular Institute의 Joseph Wu 교수님 연구실에서 박사후 연구원으로서 전문성을 더 키우기로 결심했습니다. 현재 Wu Lab에서는 mechanotransduction을 억제하여 심장 섬유화의 주범 세포유형인 myofibroblast를 다시 quiescent state로 복구/역분화시키는 연구를 진행하고 있습니다.
연구소 및 연구실 소개
Joseph Wu Lab, Stanford Cardiovascular Institute (https://med.stanford.edu/wulab.html)
Joseph Wu Laboratory는 환자 유래 유도만능줄기세포(iPSC; induced pluripotent stem cell)를 심장의 다양한 세포 유형(심근세포, 내피세포, 섬유아세포, 민무늬근세포)으로 유도분화시키는 프로토콜 개발 및 적용에 선구적 역할을 한 연구실로 알려져 있습니다. 특히 iPSC로부터 유도분화시킨 세포들을 활용하여 1) 심혈관계질환 in vitro 모델링, 2) 줄기세포 기반 cell therapy, 3) high-throughput 약물 스크리닝, 그리고 4) 빅데이터 융합 오믹스 연구를 활발히 진행하고 있습니다. Wu Lab은 또한 2,500개가 넘는 환자 샘플을 관리하는 세계 최대 규모의 iPSC Biobank (https://med.stanford.edu/scvibiobank.html)를 운영하고 있으며, Biobank가 보유하고 있는 다양한 유전적 배경의 iPSC와 CRISPR/Cas9 genome-edited line들을 세계 곳곳의 연구자들에게 무료로 제공하면서 지난 20여 년째 여러 국제 공동연구 프로젝트들을 이어가는 중입니다. 저희 연구실은 50~60명의 의학, 발달생물학, 생물리학, 생명공학 등 여러 가지 학문적 배경을 가진 박사후 연구원들이 모인 연구실로서 큰 규모에서 오는 다양한 전문성과 활발한 아이디어의 교류에서 오는 시너지효과를 이끌어낼 수 있다는 게 가장 큰 장점이자 원동력이라고 할 수 있겠습니다.
연구내용 소개 – 연구 분야, 최근 연구 소개 등
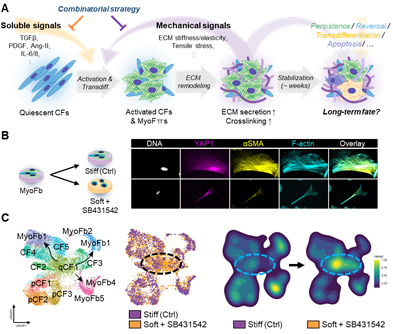
* Figure-1. Schematic summary
심근경색(심장마비), 동맥경화, 고혈압, 당뇨 등을 포함한 대다수의 심혈관계 질환의 공통된 결과물이자 동시에 원인이기도 한 섬유증/섬유화는, 조직 내 quiescent cardiac fibroblast들이 세포사멸, 염증 등에 의해 활성화되어 세포외기질을 과다 분비하게 되면서 조직의 기능을 저하시키는 현상입니다. Fibroblast가 활성화되는 섬유화의 초기 단계에 대해서는 기존 연구가 활발히 이루어진 반면에, 이미 활성화되어 fibroblast로부터 전환분화한 myofibroblast의 중장기적 fate를 규제하는 메커니즘에 대한 이해는 현저히 부족한 편입니다. 이전 연구들에 의하면 fibroblast들이 세포외기질을 분비하여 조직을 단단하게 굳히기도 하지만, 이렇게 단단해진 세포 주변 환경의 기계적 성질(강성) 또한 fibroblast를 활성화하는 주요 요소 중 하나로, 일종의 positive feedback loop이 형성되기로 알려져 있습니다. 저는 기계/물리적 신호를 감지하는 myofibroblast의 mechanotransduction 신호체계를 억제하여 이러한 악순환을 차단함으로써 심장 섬유화를 제어하고, 더 나아가 myofibroblast를 다시 quiescent state로 복구/역분화시키는 연구를 진행하고 있습니다. 이를 위해 UV 빛에 의해 자동 연화되는 dynamically softening hydrogel system을 활용하여 기계적 신호전달을 억제 또는 차단했을 때 myofibroblast의 반응 및 기능/구조 변화를 실시간으로 분석하고 있습니다. 또한 단일 세포 시퀀싱을 통해 fibroblast에서만 유독 높게 발현되는 mechanosensory 유전자/단백을 발견하여, 이를 억제하는 치료제를 iPSC 유래 cardiac fibroblast, 3D engineered heart tissue, 그리고 압력 과부화 생쥐 모델에서 테스팅 중입니다. 이번 연구는 myofibroblast의 중장기적 fate regulation에 대한 이해를 증진함과 동시에 심장 섬유화를 타겟팅한 첫 proof-of-concept mechano-therapeutics를 개발했다는 데 의의가 있으며, 궁극적으로는 심근 재생의학 발전에 크게 기여할 것으로 기대됩니다.
