[국내연구자 소개] 허진 교수/부산대학교 의학전문대학원
관리자
view : 3122

- 허진 교수
부산대학교 의학전문대학원
융합의학연구실
연구분야소개
- 1. 혈관생물학분야 연구; 혈관신생의 촉진과 억제 기작/ 새로운 세포 발굴 연구.
- 2002년부터 현재까지 혈관생물학분야의 연구를 꾸준히 해옴. 인간 말초혈액의 성체줄기세포와 혈관내피전구세포 (Endothelial Progenitor Cells; EPCs)의 동정/분리/배양 및 그들의 혈관신생 촉진 기작연구를 하였음. 2004년에는 세계 최초로 인간말초혈액에서 서로 전혀 다른 특성의 2종류의 혈관내피-전구세포를 동시에 발견하는 연구성과를 저명한 혈관생물학분야 ATVB (IF=6.09)지에 게재하였고, 2005년에는 이러한 두 종류의 혈관내피-전구세포들이 생체내에서 서로의 단점을 보완하면서 혈관신생과정을 최적화 시킬 수 있다는 연구를 혈관생물학분야 최고저널인 Circulation (IF=18.89)지에 게재 함. 2007년에는 박사학위 논문으로서, 기존의 전세계 과학자들이 단순히 혈관내피-전구세포 colony라고 부르던 것을 심층 분석하여, 그 colony의 정체가 angiogenic 한 monocyte와 CD31/CXCR4/CD3 양성인 혈관신생 특이적 T 세포 (angiogenic T cell)로 구성되어 있음을 세계 최초로 밝혔고 그 업적을 Circulation (IF=18.89)지에 게재 함. 이러한 인간 성체줄기세포들에 관한 연구들은 그 중요성을 세계적으로 인정받아, 현재 Google Scholar에 따르면 각 논문의 피인용 회수가 2004년 ATVB 1388회, 2005년 Circulation 656회, 2007년 Circulation 213회에 달함. 2011년 세계 최초로 인간말초혈액세포의 3차원 배양에 성공하여, 여러 종류의 줄기-전구세포 (조혈모세포; 혈액줄기세포, 혈관내피전구세포, 림프관내피세포, 인슐린분비세포)를 증폭시킴과 동시에 인간단핵구의 혈관신생을 촉진하는 배양법을 개발함. 이렇게 만들어진 인간혈액세포 구체를 BBHS (blood-born hematosphere)라고 명명 하였고, 그 관련연구를 저명한 학술지인 Cell Research 2011 (IF=15.39), Biomaterials 2013 (IF=8.8), Molecular Therapy 2014 (IF=7.0) 등에 6편 발표하였음. 현재는 이러한 연구결과들을 바탕으로 혈관신생을 촉진시키고 억제시키는 새로운 세포와 바이오마커 발굴에 관한 연구를 진행하고 있음.
- 2. 조혈모세포 (hematopoietic stem cell)과 그들의 보금자리 (niche)에 관한 연구.
- 2016년에는 KAI1을 발현하는 최상위 조혈모세포 (KAI1+LT-HSC)와 DARC를 발현하는 대식세포 (DARC+ macrophage)를 발견하고 그들의 역할을 밝힘. 골수에 존재하는 혈액세포들의 조상인 혈액-줄기세포들 중에서, 가장 젊고 분화재생 능력이 뛰어난 최상위 혈액-줄기세포에만 카이-원(KAI1; CD82)분자가 특이적으로 발현된다는 것을 세계최초로 밝혀냄.
더 나아가, 이 카이-원 분자는 면역을 담당하는 대식세포*(macrophage)의 다크 단백질**(DARC; CD234)과 상호작용하여 최상위 혈액-줄기세포를 활동 없이 잠들어 있는 상태로 유지시킬 수 있음을 밝혔다. * 대식세포(macrophage) : 백혈구의 한 종류이며 외부로부터 침입한 병원균 및 세포 파괴물 등을 포식하여 소화하는 식세포작용을 함. ** 다크 단백질(Duffy Antigen Receptor for Chemokines, CD234, DARC): 적혈구의 표면에 위치한 막 단백질 중 하나로, 보통 케모카인 (Chemokine)의 운송 역할을 하는 것으로 알려져 있었음. 본 연구에서 대식세포에서도 다크 단백질을 발현하는 것을 규명하였으며, 혈액-줄기세포의 카이-원(CD82)과 상호작용하여 줄기세포의 휴면을 유지시키는 기능을 새로 밝힘. 기존 연구에서는 골수 내에서 잠자고 있는 혈액-줄기세포들을 깨운 후에 그 수를 증폭시킬 수는 있었으나, 이런 방식으로 증폭된 혈액-줄기세포들은 장기적으로 혈액을 만들 수 있는 기능이 없어진다는 한계*가 있었다. * 증폭과정에서 최상위 혈액-줄기세포들은 점차 감소하고 분화재생능력이 낮은 전구 세포 또는 분화된 세포들이 늘어나, 장기 조혈 기능이 사라지게 됨. 본 연구 성과는 이러한 난제에 대한 해결책을 제시하고 있다. 즉, 최상위 혈액-줄기세포들의 증폭 과정 중 적절한 시점에 다크 단백질을 발현하는 대식세포 또는 재조합 다크 단백질을 처리하여 혈액-줄기세포들을 다시 기능과 젊음을 유지한 채로 잠재워서 저장할 수 있는 핵심 기술을 개발한 것임. 젊음을 유지한 채로 최상위 혈액-줄기세포를 대량으로 증폭, 보관하는 방법이 상용화되면, 줄기세포가 필요한 환자들에게 신속하게 최상위줄기세포를 공여하는 혈액-줄기세포은행을 만들 수 있는 길이 열리게 됨. 응용분야로서는, 면역-세포 및 인공혈액을 제작하는 곳에 이 기술을 이용할 수 있으며, 백혈병과 골수부전으로 인한 악성빈혈의 치료제를 개발하고, 골수이식 기술을 최적화하여 환자치료에 적용 가능함.
[카이-원(CD82)에 의한 최상위 혈액 줄기세포(LT-HSC)의 세포주기 조절 기전 설명]
골수에서 최상위 혈액줄기세포의 카이-원(CD82) 분자와 대식세포의 다크(DARC)가 결합하면, 최상위 혈액줄기세포는 활동 없이 잠들어 있는 세포주기 상태(휴면)로 유지됨.

[ 본 연구 결과를 한눈에 설명하는 그림 ]
[윗 패널: 평상시의 골수상태] 최상위 혈액줄기세포(아기 고양이)인 LT-HSC는 특이하게 카이-원(CD82)단백질을 발현하고 있는데, 이것의 파트너인 다크(DARC) 단백질은 대식세포(어미 고양이)의 표면에 발현. 즉 평상시에는 카이-원(CD82)-다크(DARC)의 결합으로 인해서 대식세포가 최상위 혈액줄기세포를 보호하여 휴면상태에 있도록 배려함.
[아랫 패널 : 골수가 파괴된 후 복구상태] 골수에 독성약물이나 방사선조사에 의해서 골수의 세포들이 전멸하게 되면, 구원세포로서 그동안 동면상태에 있던 최상위 혈액줄기세포의 표면에 카이-원(CD82)이 사라지면서 LT-HSC가 잠에서 깨어나 증식/분화를 시작함. 그 결과 하위 혈액줄기-전구세포인(HSPCs; hematopoietic stem-progenitor cells) ST-HSC, MPP가 태어나고, 그 이하 모든 혈액세포들, 백혈구/적혈구/혈소판 등이 재생하게 됨.
즉, 카이-원(CD82)이 있으면 최상위 혈액줄기세포가 휴면상태로 영원히 생명을 유지하게 되며, 골수가 파괴되어 혈액세포가 필요하게 되면, 카이-원(CD82)이 사라지면서 최상위 줄기세포가 증식/분화를 하게 되어 필요한 혈액세포들을 만들어 낸다는 것임. - 3. KAI1 단백질 연구의 선두팀으로 새로운 역할들을 규명 함
- 기존의 KAI1연구들은 T세포의 활성화관련 또는 종양세포 전이조절에 관한 내용이었으며 세포막에서 발현되는 KAI1의 역할에 한정되었음. 본 연구팀은 세계 최초로 이 KAI1 단백질이 골수 내 최상위 조혈모세포에 존재하며, 세포주기를 조절한다는 연구결과를 얻어서 2016년 4월 Cell Stem Cell (IF=23.29)지에 게재 함.13 이 연구를 수행함과 동시에 혈관 주변세포 (pericyte) 표면의 KAI1과 재조합 KAI1 단백질이 혈관생성을 억제 시킨다는 연구 결과를 얻었고, 후속 연구들을 진행중임. 현재 여러 편의 논문과 특허들을 준비 중에 있음.
- 4. 혈관억제 신물질인 막단백질 K (KAI1/CD82)를 이용한 망막혈관신생조절 연구와 습성노인성황반변성 치료 원천기술 개발
- 2017년부터 한국연구재단의 지원으로 중견연구과제를 수행하고 있음. 이는 실명을 유발하는 대표적 난치•만성 망막혈관질환인 습성 노인성 황반변성(Wet Age-related Macular Degeneration)을 극복하기 위한 세계최고 수준의 신개념 항 혈관신생 치료제의 개발을 목표로 함. 기존의 치료방법들은 모두 단일 혈관신생촉진인자로 인한 신호전달을 차단하는 일차원적이고 수동적인 방법이었으나, 본 연구진은 다양한 혈관신생 신호전달을 차단하여 직접적으로 혈관신생억제가 가능한 혈관세포들의 막 단백질K를 세계 최초로 발굴하였음. 혈관신생의 핵심 브레이크인 막 단백질 K의 활성화를 통한 근본적이고 지속적인 혈관신생억제 기술 개발임. 따라서 본 연구를 통해서 혈관조절 연구분야에서 세계를 선도하는 차세대기술을 확립하고 난치•만성 망막혈관질환의 근본적 치료가 가능한 원천기술을 선점하고자 함.

- 4-1 본 연구의 차별성 (기존 항-혈관신생 제제 연구 대비)
- • 시판되는 항-혈관신생 제제와 다른 작용기전을 가지며 부작용이 없는 새로운 치료제 개발: VEGF를 중화하는 수동적인 방식이자 VEGF에만 작용하는 기존 항-혈관신생 제제와 달리, 본 연구에서는 VEGF, FGF, PDGF 등 여러 가지 혈관신생 촉진인자가 존재하는 조건에서도 혈관신생을 차단하며, 부작용이 없는 새로운 치료제를 개발하고자 함.
• 망막세포를 삼차원 배양을 통한 생체 내 환경을 그대로 재현함: 기존 혈관신생기작의 연구들은 보통 하나의 세포를 평면에서 배양하는 것으로, 실제적인 생체 내 환경과는 차이가 큼. 본 연구진은 자체 보유한 독창적인 생체 내 세포의 삼차원 배양기술을 바탕으로 3가지 종류의 세포를 삼차원 입체배양 하여서 망막 내의 미세환경을 시험관에서 구현함으로써 단백질 기능연구 및 다양한 신호전달 연구를 수행 중임.
• 미세 유체공학 (microfluidics) 신기술 도입을 통한 막 단백질 K의 최적 처리농도 선정: 본 연구진은 공과대학 연구진과의 다학제 공동연구를 통해 미세 유체공학 기술 (microfluidic chip)을 도입하여 효과적인 혈관신생 억제를 위한 막 단백질 K의 최적 처리농도를 연구 중임. - 4-2 학문적 파급효과
- • 현재까지는 혈관신생 과정에서 내피세포와 주피세포가 어떻게 상호작용하는지 부분적으로만 알려져 있음. 본 연구는 두 가지 세포가 막 단백질 K를 통해 어떻게 상호작용하는지 규명하여 근본적이고 부작용을 최소화한 혈관신생 억제제 개발을 목표로 함.
• 막 단백질 K가 속한 테트라스파닌 (tetraspanin) 단백질들은 생체 내에서 광범위하게 발현되며 서로 다른 종 간에 매우 잘 보존된 (evolutionally conserved) 분자임에도 불구하고 그 생리학적 기능에 대한 연구가 많이 되어있지 않음. 본 연구팀이 규명한 KAI1 단백질의 기존 기능인 조혈모세포 세포주기 억제 및 항혈관신생 기능 외의 망막색소상피세포나 다른 면역세포에 미치는 새로운 기작을 발견하게 된다면, 안과학, 면역학, 혈관/종양생물학 및 세포생물학 분야에 큰 파급효과가 있음. 또한 기존에 분자조력자로만 알려져 있던 KAI1 이외의 다른 테트라스파닌 분자에 대한 새로운 기능 규명 연구를 수행 중.
• Wet-AMD (습성 노인성황반변성)는 선진국 실명의 주요 원인이며 루센티스, 아바스틴 등 기존 anti-VEGF 약제의 선전에도 불구하고, 여전히 10-15%의 환자군에서 wet AMD가 재발함. 본 연구진은 인간 재조합 막단백질 K를 활용하여 항-VEGF 치료가 듣지 않는 환자군을 위한 이차 치료제 (second line therapy: 일차 치료가 효과가 없을 때 사용하는 약) 를 연구 중임. 또한 향후 다른 테트라스파닌 분자들로 연구의 지평을 넓혀 그들의 생리학적 중요성을 밝힌다면 국내 원천기술의 추가 확보가 가능함. 본 기술로 재발 환자군을 대상으로 하는 치료제가 개발된다면 5조 원 규모의 세계 시장 (전체 wet AMD 시장의 10%로 추산)에 진입 가능함. 또한 임상 경험 축적을 통해 효능이 입증된다면 아일리아처럼 이차 치료제에서 일차 치료제 (first line therapy) 로 리포지셔닝 (repositioning) 되어 더 큰 시장성을 지닐 수 있음. - 5. 딥러닝 기반 단세포 RNA 시퀀싱 분석을 통한 혈관 망막질환 관련 새로운 세포와 바이오마커 발굴
- • 최근 생명과학분야에서 single-cell RNA 유전체 분석기법이 도입이 되어, 생체조직내 다양한 세포들에서의 유전체변화를 전체적으로 심층분석하게 되었을 뿐만 아니라 기존에 알려지지 않았던 새로운 세포타입을 발견함과 동시에 다양한 바이오마커들을 발굴하여 그 전반적인 기능을 연구하는 혁신이 일어나고 있음. 예로 미국 하버드 대학의 Sanes 그룹은 망막양극신경세포 (retinal bipolar neuron)의 새로운 2가지 형태의 세포를 발견하여 망막세포 분류학을 발전시키는 업적으로 2016년 8월 Cell 지에 게재하였음. 영국 버밍엄대학의 Buckley 그룹은 fibroblast activation protein-α (FAPα) 양성 섬유아세포를 발견하였고, 더 나아가 FAPα+THY1+ 과 FAPα+THY1- 세포의 해부학적 위치와 기능을 밝힘으로써 관절염의 치료에 중요한 단서를 제공하여 2019년 5월 Nature 지에 게제 함. 미국 하버드 대학의 Scadden 그룹은 골수내의 세포들을 총 분석하여 새로운 골수세포들을 발견함으로써 백혈병치료에 중요한 단서를 제공하여 2019년 6월 Cell 지에 게재 함. 이러한 세계적 흐름에 발맞추어, 본 연구진은 부산대학교 의과대학 김윤학 교수 연구팀과 함께 딥러닝 기반 단세포 RNA 시퀀싱 (single-cell RNA sequencing based on deep-learning) 분석기법을 확립하고자 하며, 이를 혈관성 망막질환에 응용하여 질환의 발병과 치료에 핵심적인 새로운 세포를 발굴함과 동시에 차세대 바이오마커를 발굴하고 그 기능과 치료 메카니즘을 밝히려 함.
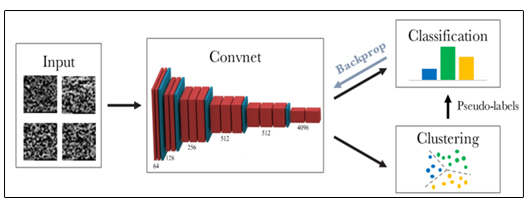 [유전자들을 이미지화하여 깊은 딥러닝 네트워크를 이용한 Deep clustering 기법]
[유전자들을 이미지화하여 깊은 딥러닝 네트워크를 이용한 Deep clustering 기법]
향후 다양한 세포아형에 대한 확실한 정보를 가진 single cell RNA seq데이터를 선별하여 deep clustering network을 개발할 것임. 표준화 데이터를 정사각형 형태로 이미지화한 후, convolutional neural network를 이용해 학습시킴으로써, 딥러닝 네트워크 중 depth가 깊은 네트워크를 single cell RNA seq에 적용시켜 기존방법대비 더 정확한 clustering 방법을 최초로 개발하여, 혈관성 망막질환에 중요한 역할을 하는 새로운 세포와 바이오 마커를 발굴 하려 함.
대표 연구논문들
- CD82/KAI1 Maintains the Dormancy of Long-Term Hematopoietic Stem Cells through Interaction with DARC-Expressing Macrophages
Jin Hur*, Jae-Il Choi* et. al. Cell Stem Cell. 2016 Apr 7;18:508-21
KAI1(CD82)-DARC(CD234) axis in the stem cell niche
Jin Hur, Sung Hee Baek, Hyo-Soo Kim. Cell Cycle. 2016 Aug 2;15(15):1945-7.
Priming mobilized peripheral blood mononuclear cells with the "activated platelet supernatant" enhances the efficacy of cell therapy for myocardial infarction of rats
Kang J*, Hur J*, Kang JA*, et. al. Cardiovascular Therapeutics. 2016; Aug 34(4):245-53
M-CSF from Cancer Cells Induces Fatty Acid Synthase and PPARβ/δ Activation in Tumor Myeloid Cells, Leading to Tumor Progression.
Park J*, Lee SE*, Hur J*, et. al. Cell Rep. 2015 Mar 4.
Human podoplanin-positive monocytes and platelets enhance lymphangiogenesis through the activation of the podoplanin/CLEC-2 axis.
Hur J*, Jang JH*, Oh IY*, et. al. Mol Ther. 2014 Aug;22(8):1518-29.
Erythropoietin priming improves the vasculogenic potential of G-CSF mobilized human peripheral blood mononuclear cells.
Kang J*, Yun JY*, Hur J*, et. al. Cardiovasc Res. 2014 Oct 1;104(1):171-82.
Activated platelet supernatant can augment the angiogenic potential of human peripheral blood stem cells mobilized from bone marrow by G-CSF.
Kang J*, Hur J*, Kang JA*, et. al. J Mol Cell Cardiol. 2014 Oct;75:64-75. * co-first authors
Highly angiogenic CXCR4(+)CD31(+) monocyte subset derived from 3D culture of human peripheral blood.
Hur J*, Choi JI*, Yun JY* et. al. Biomaterials. 2013 Mar;34(8):1929-41.
New method to differentiate human peripheral blood monocytes into insulin producing cells: Human hematosphere culture
Hur J*, Yang JM*, Choi JI*, et. al. Biochem Biophys Res Commun. 2012 Feb 24;418(4):765-9.
Human peripheral blood-born hematosphere as a niche for hematopoietic stem cell expansion
Hur J*, Park J*, Lee SE*, et. al. Cell Res. 2011 Jun;21(6):987-90.
Identification of a Novel Role of T cells in Postnatal Vasculogenesis : Characterization of Endothelial Progenitor Cell Colonies
Jin Hur*, Han-Mo Yang*, Chang-Hwan Yoon*, et. al. October 1, 2007 Circulation
Akt Is a Key Modulator of Endothelial Progenitor Cell Trafficking in Ischemic Muscle
J. Hur*, C.-H. Yoon*, et. al. Stem Cells, July 1, 2007; 25(7): 1769 - 1778.
Intercellular Adhesion Molecule-1 Is Upregulated in Ischemic Muscle, Which Mediates Trafficking of Endothelial Progenitor Cell
Chang-Hwan Yoon*, Jin Hur*, et. al. Arterioscler. Thromb. Vasc. Biol., May 2006; 26: 1066 - 1072.
Synergistic Neovascularization by Mixed Transplantation of Early Endothelial Progenitor Cells and Late Outgrowth Endothelial Cells: The Role of Angiogenic Cytokines and Matrix Metalloproteinases
Chang-Hwan Yoon*, Jin Hur*, Circulation, Sep 2005; 112: 1618 - 1627.
Augmentation of Therapeutic Angiogenesis Using Genetically Modified Human Endothelial Progenitor Cells with Altered Glycogen Synthase Kinase-3 Activity
Jin-Ho Choi*, Jin Hur*, J. Biol. Chem., Nov 2004; 279: 49430 - 49438
Characterization of Two Types of Endothelial Progenitor Cells and Their Different Contributions to Neovasculogenesis.
Jin Hur*, Chang-Hwan Yoon*, et. al. Arterioscler. Thromb. Vasc. Biol., Feb 2004; 24: 288 - 293
